La molécula de RNA del virus se compone de unas 11 kilobases. En su extremo 5′, como si de un mRNA se tratase, posee la “caperuza” (o CAP, en inglés): una región no codificante necesaria para la estabilidad del RNA y su correcta traducción. Sin embargo, en el extremo 3′ no se encuentra la otra región característica de los mRNA, la cola poli-A, formada por varios nucleótidos de adenina.
Como ya mencionamos anteriormente, el RNA del WNV es de polaridad positiva, y esto hace que sea necesario un cambio de la polaridad de la molécula para que, a partir de la hebra negativa resultante (que actúa como molde), se puedan sintetizar más copias de la hebra positiva, las cuales actuarán como mRNA. La traducción de este mRNA origina una poliproteína, pues solo hay un marco de lectura abierto (llamado ORF). Esta poliproteína necesita la acción de proteasas que rompan algunos de sus enlaces peptídicos para dar lugar a las distintas proteínas que formarán el nuevo virión, en concreto diez, las cuales pueden clasificarse en estructurales y no estructurales, tal y como se observa en la siguiente imagen:

Figura 1: RNA del WNV y proteínas que codifica
El primer segmento del RNA del virus, correspondiente con la sección “structural” en la figura 1, codifica las proteínas estructurales, es decir las que participan en la formación de la estructura del virus:
- La proteína C estabiliza el RNA y forma la nucleocápside icosaédrica del virus.
- La proteína M, presente en la envoltura del virus junto con la proteína E, tiene dos dominios que atraviesan dicha envoltura y un ectodominio (dominio externo a la envoltura). Esta proteína puede permanecer en su forma inmadura, llamada prM, que confiere al virus un carácter menos infeccioso. Tras su maduración a la forma M, adquiere más capacidad infecciosa. Se cree que puede tener una función de chaperona, la cual ayudaría al correcto plegamiento de la proteína E.
- La proteína E es la más importante de la envoltura. Se trata de un dímero proteico glicosidado responsable de la detección del sistema inmunitario, que participa en la adsorción del virus por parte de la célula hospedadora. La disposición de esta proteína E, junto con la M, da una apariencia esférica al virus.
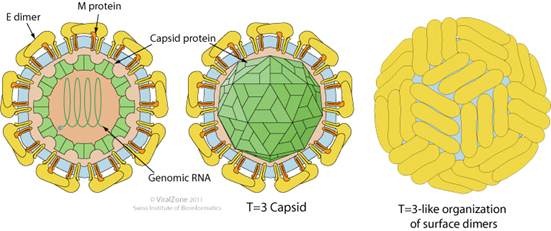
Figura 2: estructura y morfología del WNV
El segundo segmento de la molécula de RNA, correspondiente con la sección “nonstructural” en la figura 1, es el encargado de codificar las proteínas no estructurales del virus. Aunque no se conocen del todo los mecanismos de algunas de estas proteínas, se cree que están implicadas de forma directa o indirecta con la replicación del material genético.
- Las proteínas NS2A, NS2B, NS4A y NS4B (correspondientes a las regiones 2A, 2B, 4A y 4B en la figura 1) podrían estar relacionadas con el ensamblamiento y/o anclaje de los complejos replicativos en la envoltura.
- La proteína NS1 es una glicoproteína rica en cisteína, con tres sitios de glicosidación bien conservados que reducen la efectividad del virus si sufren alguna mutación. Su principal función es formar enlaces disulfuro, esenciales para la viabilidad del virus.
- La proteína NS3 es una proteasa de serina que es activa mientras está asociada a la proteína NS2B. El complejo NS3-NS2B escinde por los lugares correspondientes a la poliproteína formada tras la traducción.
- La proteína NS5 es la más larga de todas las del virus y la más conservada entre todos los Flavivirus. En su extremo N-terminal contiene la secuencia de la enzima S-adenosilmetionina transferasa, capaz de dar grupos metilos; y en su extremo C-terminal contiene una porción de la secuencia de la RNA-polimerasa.
